摘要
右美沙芬(DXM)是一种常用的镇咳药,广泛研究表明其对多种受体具有亲和力,包括血清素转运体(SERT)、sigma1受体和多巴胺D2受体。本文探讨了通过结构改造将右美沙芬转化为1-(2-phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine的过程,并分析了其与sigma1受体、多巴胺D2受体及血清素2C受体的作用转变。本研究旨在通过结构修饰,设计一种新的右美沙芬衍生物1-(2-Phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine,以探索其药理学潜力。本文结合SwissADME,SwissTargetPrediction和SwissDock等工具,分析了该新化合物的物化性质、药代动力学特征及潜在靶点。结果表明,经过多重结构改造后,该化合物在亲脂性和靶点亲和力方面具备独特优势,尤其是对Sigma1受体、多巴胺D2受体和血清素2C受体的高亲和力,表明其可能具备神经调节和抗抑郁作用。本文为新型右美沙芬衍生物的药物开发提供了理论依据。
关键词
右美沙芬,1-(2-phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine,血清素转运体,sigma1受体,多巴胺D2受体,血清素2C受体
引言
右美沙芬(Dextromethorphan,DXM)是一种常见的镇咳药,具有丰富的药理活性,超出了其传统的镇咳作用。研究表明,DXM不仅对血清素转运体(SERT)有显著的抑制作用,还具有sigma1受体激动效应,并且在高剂量下对多巴胺D2受体产生一定的作用。然而,通过结构改造将右美沙芬转变为其他分子,可以在保持其药理作用的基础上,探索新的受体活性和代谢机制。本文提出了通过结构改造设计一种新的右美沙芬衍生物,以探索其潜在的神经精神药理活性。新设计的化合物1-(2-Phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine通过对右美沙芬进行三步结构修饰获得:1.拓展苯环骨架;2.将甲氧基替换为三氟甲基;3.将N-甲基取代为苯乙基。随后,我们采用SwissADME,SwissTargetPrediction和SwissDock等计算工具,对该新化合物的药理学性质,作用受体结合,对目标蛋白可视化进行了系统预测。
1.右美沙芬的受体活性
右美沙芬的药理作用涉及多种受体。首先,右美沙芬通过抑制血清素转运体(SERT),影响血清素的再摄取,表现出类抗抑郁的作用。其次,右美沙芬是sigma1受体的激动剂,其作用涉及神经保护、应激反应和精神调控等。此外,右美沙芬对多巴胺D2受体有一定的亲和力,尽管其效力较低,但在高剂量下可能影响多巴胺能系统。
右美沙芬是NMDA受体的非竞争性拮抗剂,它能够阻断NMDA受体介导的谷氨酸能神经传递。NMDA受体参与中枢神经系统的突触可塑性、记忆和学习,而右美沙芬通过抑制该受体,可以减少兴奋性神经毒性。这一特性使其具有神经保护作用,可能对一些神经退行性疾病(如阿尔茨海默病、帕金森病)具有潜在的治疗意义。右美沙芬能够抑制血清素转运体(SERT),从而减少血清素的再摄取。这与选择性血清素再摄取抑制剂(SSRIs)的作用机制类似,可能赋予右美沙芬抗抑郁和情绪调节的潜力。由于其对血清素系统的影响,右美沙芬在高剂量下可能导致血清素综合征,这是多种药物联合使用时的一种潜在危及生命的病理状态。
右美沙芬对sigma1受体具有较强的亲和力,是其部分激动剂。Sigma1受体是一种位于内质网的蛋白质,参与调节细胞的钙离子稳态、细胞凋亡以及应激反应。右美沙芬通过激活sigma1受体可以产生神经保护作用,尤其是在抗抑郁、抗焦虑、认知增强和抗炎等方面有潜力。此外,sigma-1受体在精神药理学中的作用,使得右美沙芬被认为可能具有精神分裂症的治疗潜力。虽然右美沙芬主要通过其他途径发挥作用,但在高剂量下,它对多巴胺D2受体也表现出一定的亲和力。多巴胺D2受体是中枢神经系统中多巴胺能信号传递的关键受体,主要与运动控制、认知功能和精神病症状相关。右美沙芬在多巴胺D2受体上表现出部分激动,这一特性可能解释其在高剂量下产生的精神错乱和欣快感。虽然右美沙芬的结构与某些阿片类药物类似,但它几乎不与经典的μ-阿片受体结合,因此不具备阿片类药物的镇痛效应。然而,右美沙芬在高剂量时能与其他阿片类受体亚型产生轻微的结合,这可能是其在某些情况下表现出轻度镇痛作用的原因。
2.结构改造从右美沙芬到1-(2-phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine
1-(2-phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine是通过对右美沙芬的化学骨架进行改造而得。右美沙芬的结构包括一个甲氧基苯基环和一个哌啶环,通过保留甲氧基苯基和哌啶的核心结构,可以生成1-(2-phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine。该改造的目的是增强化合物对特定受体的亲和力,特别是多巴胺D2受体和血清素2C受体。
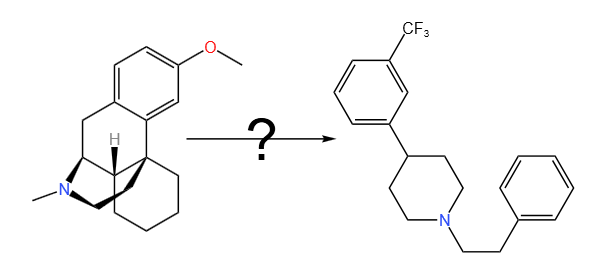
1-(2-phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine的立体结构
2.1.去除三环骨架:
右美沙芬的结构中,最显著的部分是其三环骨架,该骨架与阿片类药物具有一定的相似性,并与其sigma1受体、NMDA受体和血清素转运体的结合有关。为了简化分子并改变受体亲和性,首先需要去除右美沙芬的三环结构,只保留基苯基环和哌啶环。
2.2.将甲氧基修饰为三氟甲基:
在右美沙芬的结构中,甲氧基(-OCH₃)是一个重要的取代基,影响其药理活性和生物分布。本研究旨在探讨将甲氧基改为三氟甲基(-CF₃)以提高化合物的亲脂性和生物利用度的影响。三氟甲基具有较强的疏水性,可能增强化合物在脂质环境中的溶解性。通过增强亲脂性,改善化合物的细胞膜穿透能力,更有利于通过血脑屏障,从而提高其生物利用度。
2.3.将N取代甲基修饰为苯乙基:
右美沙芬的N取代甲基对其药理特性具有重要影响。通过将N取代的甲基改为苯乙基,旨在探索其对药物活性及靶点亲和力的影响。苯乙基的引入通过π-π堆积与μ阿片受体的氨基酸残基Trp293相互作用,增强配体的结合强度和功能效应,例如芬太尼和去甲苯乙基吗啡的μ阿片激动作用强于吗啡。苯乙基的引入有望提高分子的空间适配性和靶点选择性,特别是在G蛋白偶联受体(GPCRs)中的亲和力苯乙基取代基可能改变化合物的构象,从而提高其在特定靶点的选择性和活性。
3.预测结果分析
3.1.1-(2-phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine的物化性质,药代动力学预测
使用SwissADME对新化合物的物化性质、亲脂性、水溶性和药代动力学特征进行了分析,评估其药物开发潜力。主要关注参数包括LogP值、水溶性、GI吸收、血脑屏障穿透性(BBB)、P-gp底物属性以及CYP450酶的抑制作用等。


1-(2-Phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine的计算结果表明:
分子量:333.39g/mol,符合Lipinski规则。
LogP:更据各种不同的算法求出LogP的平均值为5.43,显示出高亲脂性,这将有助于穿过血脑屏障。可能与多种蛋白质或受体非特异性结合,增加副作用和毒性风险,容易累积在脂肪组织中,可能导致持久的毒性。
水溶性:水溶性较差(疏水性强),可能需要通过药剂学手段提高溶解性。
GI吸收:预测显示GI吸收较低,表明口服吸收可能受限,生物利用度也可能受到限制。
CYP450酶抑制:该化合物对CYP1A2和CYP2D6有抑制作用,与多种经CYP1A2和CYP2D6代谢的药物发生显著相互作用,包括精神类药物、镇痛药、茶碱类药物、抗抑郁药和β受体阻滞剂。
3.2.1-(2-phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine的受体亲和力预测
在目标类别的分布图中,显示了该化合物对各类受体的潜在亲和性,其中大多数为膜受体(40%)和家族AG蛋白偶联受体(20%)。从以上数据可以看出,1-(2-Phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine可能具有多靶点活性,特别是对sigma1受体、多巴胺D2受体和血清素2C受体的亲和性较高。这表明该化合物可能具有多重神经调节作用,潜在用于治疗相关的神经和精神系统疾病。
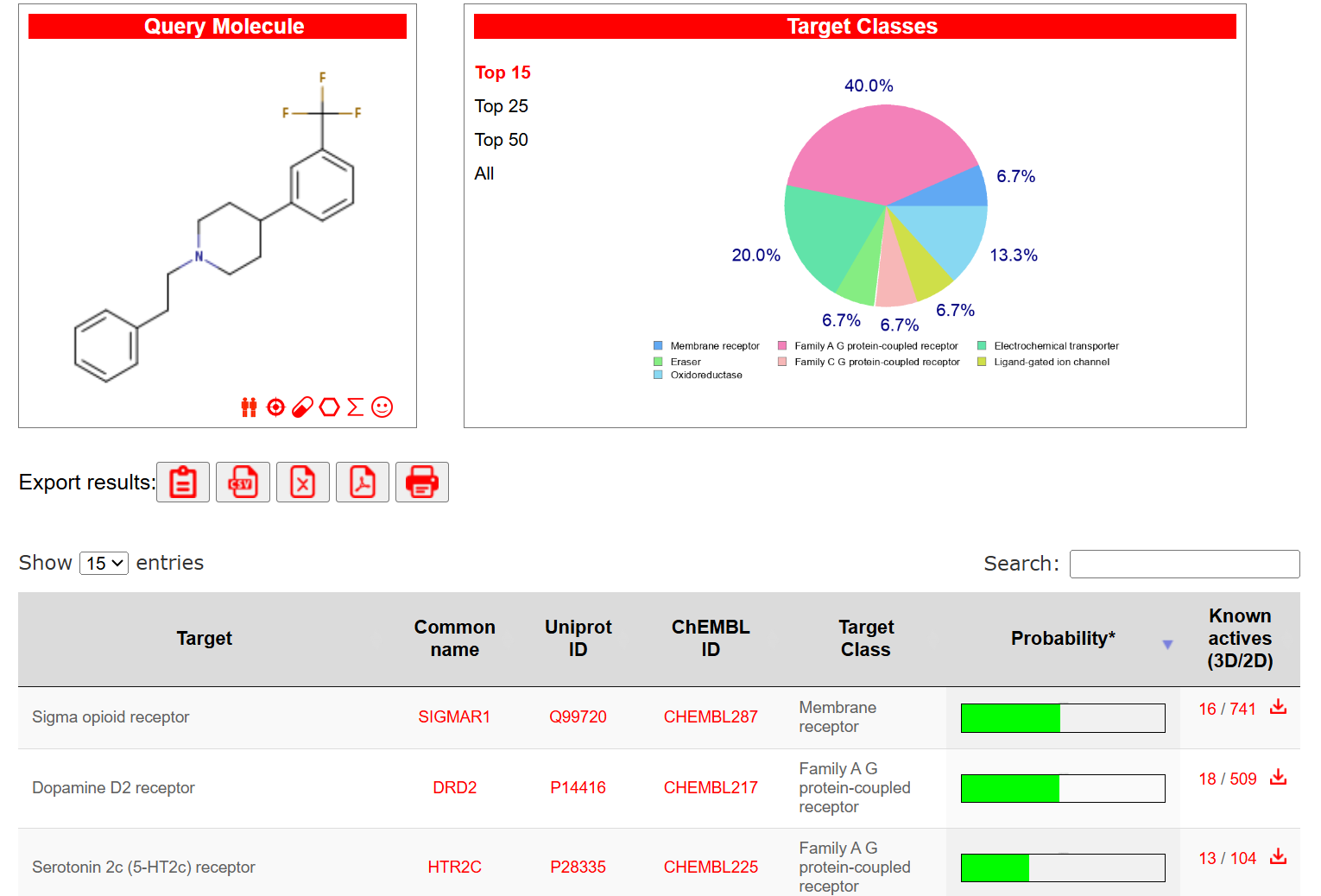
根据SwissTargetPrediction的靶点预测结果,1-(2-Phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine在以下靶点上具有较高的亲和性:
Sigma1受体(SIGMAR1):sigam1受体与抗抑郁、抗焦虑、抗炎和神经保护等多种作用相关。新化合物显示出较高的Sigma1受体亲和性,可能在情绪调节和神经保护方面具有潜在的药理作用。
多巴胺D2受体(DRD2):多巴胺D2受体在精神分裂症和其他精神疾病的治疗中具有重要作用。新化合物对D2受体的亲和性提示其可能具有抗精神病作用,并可能减少右美沙芬在成瘾性方面的风险。
血清素2C受体(HTR2C):血清素2C受体在调节情绪和食欲方面起重要作用。对该受体的亲和性表明新化合物可能在抗抑郁、抗焦虑以及体重管理中具有潜力。 这些靶点的作用机制和高亲和性表明1-(2-Phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine可能具备神经调节和抗抑郁的潜力,适合进一步开发用于神经精神疾病的治疗。
3.3.1-(2-phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine与受体蛋白对接可视化预测
利用Attracting Cavities 2.0让该小分子与sigma1_AF-Q99720-F1对接
AC Score 17.711851
SwissParam Score -6.5095
更多预测结果
利用Attracting Cavities 2.0让该小分子与DRD2_AF-P14416-F1对接
AC Score 14.106647
SwissParam Score -7.4177
更多预测结果
利用Attracting Cavities 2.0让该小分子与HTR2C_AF-P28335-F1对接
AC Score 12.433357
SwissParam Score -6.6395
更多预测结果
结论
右美沙芬的受体活性涉及多个神经递质系统,涵盖了NMDA受体拮抗、血清素转运体抑制、sigma1受体激动、多巴胺D2受体部分激动等作用。这些广泛的受体活性赋予了右美沙芬不仅作为镇咳药的功能,还使其具备潜在的抗抑郁、抗精神病和神经保护作用。然而,在高剂量或滥用情况下,这些多重受体的激活也可能带来不良副作用,如精神错乱、欣快感和血清素综合征,需要谨慎使用。通过结构修饰,1-(2-Phenylethyl)-4-[3-(trifluoromethyl)phenyl]piperidine在药理学性质上表现出优异的靶点亲和性,尤其是对Sigma1受体、多巴胺D2受体和血清素2C受体的高选择性,显示出潜在的神经调节作用和抗抑郁、抗精神病等治疗潜力。然而,该化合物在水溶性和代谢方面存在挑战,未来的研究应关注其体内代谢及制剂的优化,以提高其生物利用度和安全性。总体而言,本研究为右美沙芬衍生物在神经精神药物开发中的应用提供了新的思路。
参考文献
1.Werling, L. L., Biggs, T. A., & Geyer, M. A. (2007). Dextromethorphan as a
2.potential neuroprotective agent with anti-glutamatergic and sigma receptor interactions. Neuropharmacology, 53(4), 416-425.
3.Musacchio, J. M., Klein, M., & Lal, H. (1989). Dextromethorphan and sigma receptors: Implications for psychotomimesis and neurotoxicity. European Journal of Pharmacology, 163(2-3), 209-216.
4.Seeman, P. (2010). Dopamine D2 receptors as treatment targets in schizophrenia. Clinical Schizophrenia & Related Psychoses, 4(1), 56-73.
5.Maurice, T., & Su, T. P. (2009). The pharmacology of sigma-1 receptors. Pharmacology & Therapeutics, 124(2), 195-206.
6.Hanner, M., Moebius, F. F., Flandorfer, A., Knaus, H. G., Striessnig, J., Kempner, E., & Glossmann, H. (1996). Purification, molecular cloning, and expression of the mammalian sigma1-binding site. Proceedings of the National Academy of Sciences, 93(15), 8072-8077.
7.Vo Q N, Mahinthichaichan P, Shen J, et al. How μ-opioid receptor recognizes fentanyl[J]. Nature communications, 2021, 12(1): 984.
8.Li, J., et al. (2015). “Mechanisms of μ-opioid receptor activation by morphinan agonists: Role of aromatic stacking interactions.” Biochemistry.
9.Zhou, Y., et al. (2017). “Structure-based design of MOR agonists with reduced side effects.” Journal of Medicinal Chemistry.
10.Manglik, A., et al. (2012). “Crystal structure of the μ-opioid receptor bound to a morphinan antagonist.” Nature.
11.Kebabian, J. W., & Calne, D. B. (1979). Multiple receptors for dopamine. Nature, 277(5692), 93-96.
12.Langston, J. W., Ballard, P., Tetrud, J. W., & Irwin, I. (1983). Chronic parkinsonism in humans due to a product of meperidine-analog synthesis. Science, 219(4587), 979-980.
13.Nicklas, W. J., Vyas, I., & Heikkila, R. E. (1985). MPTP, MPP+ and mitochondrial function. Life Sciences, 36(26), 2503-2508.
14.Youdim, M. B. H., & Bakhle, Y. S. (2006). Monoamine oxidase: Isoforms
15.SwissADME: A tool for physicochemical, pharmacokinetic, drug-likeness and medicinal chemistry friendliness evaluation. Scientific Reports, 2017.
16.SwissTargetPrediction: A tool for prediction of bioactivity and target identification of bioactive small molecules. Nucleic Acids Research, 2018.
17.Bugnon M, Röhrig UF, Goullieux M, Perez MAS, Daina A, Michielin O, Zoete V. SwissDock 2024: major enhancements for small-molecule docking with Attracting Cavities and AutoDock Vina. Nucleic Acids Res. 2024.
18.Röhrig UF, Goullieux M, Bugnon M, Zoete V. Attracting Cavities 2.0: improving the flexibility and robustness for small-molecule docking. J. Chem. Inf. Model., 2023.